domingo, 7 de outubro de 2007
AMINOÁCIDOS - Conceito
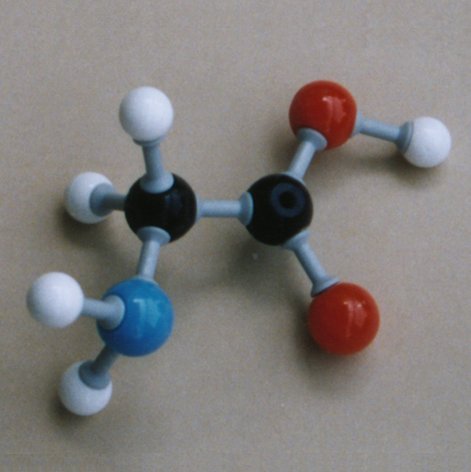
Em química, um aminoácido é qualquer molécula que contém simultaneamente grupos funcionais amina e ácido carboxílico. Em bioquímica, este termo é usado como termo curto e geral para referir os aminoácidos alfa: aqueles em que as funções amino e carboxilato estão ligadas ao mesmo carbono.
Aminoácidos - Classificação
Os aminoácidos podem ser classificados:
- nutricionalmente;
- quanto ao radical e
- quanto ao seu destino.
- nutricionalmente;
- quanto ao radical e
- quanto ao seu destino.
Aminoácidos - Classificação nutricional
Aminoácidos não-essenciais
Aminoácidos não-essenciais são aqueles os quais o corpo humano pode sintetizar. São eles: Glicina, Alanina, Arginina, Serina,Cisteína,Tirosina, Ácido aspártico, Ácido glutâmico, Histidina, Asparagina,Glutamina, Taurina e Prolina.
Aminoácidos essenciais
Os aminoácidos essenciais são aqueles que não podem ser produzidos pelo corpo humano. Dessa forma, somente podemos adquirí-los pela ingestão de alimentos, vegetais ou animais. São eles:Arginina, Fenilalanina, Histidina, Isoleucina, Leucina, Lisina, Metionina, Treonina, Triptofano e Valina.
Aminoácidos não-essenciais são aqueles os quais o corpo humano pode sintetizar. São eles: Glicina, Alanina, Arginina, Serina,Cisteína,Tirosina, Ácido aspártico, Ácido glutâmico, Histidina, Asparagina,Glutamina, Taurina e Prolina.
Aminoácidos essenciais
Os aminoácidos essenciais são aqueles que não podem ser produzidos pelo corpo humano. Dessa forma, somente podemos adquirí-los pela ingestão de alimentos, vegetais ou animais. São eles:Arginina, Fenilalanina, Histidina, Isoleucina, Leucina, Lisina, Metionina, Treonina, Triptofano e Valina.
Aminoácidos - Classificação quanto ao radical
A classificação quanto ao radical pode ser feita em:
Aminoácidos apolares
Apresentam radicais de hidrocarbonetos apolares ou hidrocarbonetos modificados, exceto a glicina. São radicais hidrófobos.
Glicina: H- CH (NH2) - COOH
Alanina: CH3- CH (NH2) - COOH
Leucina: CH3(CH2)3-CH2-CH (NH2)- COOH
Valina: CH3-CH(CH3)-CH (NH2)- COOH
Isoleucina: CH3-CH2-CH (CH3)-CH (NH2)- COOH
Prolina:-CH2-CH2-CH2- ligando o grupo amino ao carbono alfa
Fenilalanina: C6H5-CH2-CH (NH2)- COOH
Triptofano: R aromático- CH (NH2)- COOH
Metionina: CH3-S-CH2-CH2- CH (NH2)- COOH
Aminoácidos polares neutros
Apresentam radicais que tendem a formar pontes de hidrogênio.
Serina: OH-CH2- CH (NH2)- COOH
Treonina: OH-CH (CH3)- CH (NH2)- COOH
Cisteina: SH-CH2- CH (NH2)- COOH
Tirosina: OH-C6H4-CH2- CH (NH2)- COOH
Asparagina: NH2-CO-CH2- CH (NH2)- COOH
Glutamina: NH2-CO-CH2-CH2- CH (NH2)- COOH
Aminoácidos ácidos
Apresentam radicais com grupo carboxílico.São hidrófilos.
Ácido aspártico: HCOO-CH2- CH (NH2)- COOH
Ácido glutâmico: HCOO-CH2-CH2- CH (NH2)- COOH
Aminoácidos básicos
Apresentam radicais com o grupo amino. São hidrófilos
Arginina: HN=C(NH2)-NH-CH2-CH2-CH2- CH (NH2)- COOH
Lisina: NH2-CH2-CH2-CH2-CH2- CH (NH2)- COOH
Histidina: H-(C3H2N2)-CH2- CH (NH2)- COOH
Aminoácidos alfa
Fórmula geral
São aqueles que apresentam fórmula geral: R - CH (NH2)- COOH onde R é um radical orgânico. No aminoácido glicina o radical é o elemento H
O carbono ligado ao radical R é denominado carbono 2 ou alfa.
Simbologia e Nomenclatura
Na nomenclatura dos aminoácidos, a numeração dos carbonos da cadeia principal é iniciada a partir do carbono da carboxila.
Aminoácidos apolares
Apresentam radicais de hidrocarbonetos apolares ou hidrocarbonetos modificados, exceto a glicina. São radicais hidrófobos.
Glicina: H- CH (NH2) - COOH
Alanina: CH3- CH (NH2) - COOH
Leucina: CH3(CH2)3-CH2-CH (NH2)- COOH
Valina: CH3-CH(CH3)-CH (NH2)- COOH
Isoleucina: CH3-CH2-CH (CH3)-CH (NH2)- COOH
Prolina:-CH2-CH2-CH2- ligando o grupo amino ao carbono alfa
Fenilalanina: C6H5-CH2-CH (NH2)- COOH
Triptofano: R aromático- CH (NH2)- COOH
Metionina: CH3-S-CH2-CH2- CH (NH2)- COOH
Aminoácidos polares neutros
Apresentam radicais que tendem a formar pontes de hidrogênio.
Serina: OH-CH2- CH (NH2)- COOH
Treonina: OH-CH (CH3)- CH (NH2)- COOH
Cisteina: SH-CH2- CH (NH2)- COOH
Tirosina: OH-C6H4-CH2- CH (NH2)- COOH
Asparagina: NH2-CO-CH2- CH (NH2)- COOH
Glutamina: NH2-CO-CH2-CH2- CH (NH2)- COOH
Aminoácidos ácidos
Apresentam radicais com grupo carboxílico.São hidrófilos.
Ácido aspártico: HCOO-CH2- CH (NH2)- COOH
Ácido glutâmico: HCOO-CH2-CH2- CH (NH2)- COOH
Aminoácidos básicos
Apresentam radicais com o grupo amino. São hidrófilos
Arginina: HN=C(NH2)-NH-CH2-CH2-CH2- CH (NH2)- COOH
Lisina: NH2-CH2-CH2-CH2-CH2- CH (NH2)- COOH
Histidina: H-(C3H2N2)-CH2- CH (NH2)- COOH
Aminoácidos alfa
Fórmula geral
São aqueles que apresentam fórmula geral: R - CH (NH2)- COOH onde R é um radical orgânico. No aminoácido glicina o radical é o elemento H
O carbono ligado ao radical R é denominado carbono 2 ou alfa.
Simbologia e Nomenclatura
Na nomenclatura dos aminoácidos, a numeração dos carbonos da cadeia principal é iniciada a partir do carbono da carboxila.
Aminoácidos - Classificação quanto ao destino
Quanto ao destino
Essa classificação é dada em relação ao destino tomado pelo aminoácido quando o grupo amina é excretado do corpo na forma de uréia(mamíferos), amônia(peixes) e ácido úrico(Aves e répteis).
Destino cetogênico
Quando o álcool restante da quebra dos aminoácidos vai para qualquer fase do Ciclo de Krebs na forma de Acetil coenzima A ou outra substância.
Destino glicogênico
Quando o álcool restante da quebra dos aminoácidos vai para a via glicolítica.
Ocorrência
Os aminoácidos alfa ( cerca de vinte ) são constituintes de todas as proteínas e peptídeos, portanto, de toda a matéria viva.
Todos os aminoácidos constituintes das proteínas são alfa aminoácidos. As proteínas são alfa-polímeros formados por alfa-aminoácidos. Alguns autores relatam que para formar uma proteína é necessário uma cadeia com mais de 50 aminoácidos. Uma cadeia formada por dois alfa aminoácidos é um dipeptídeo, até 50 alfa-aminoácido um polipeptídeo.
Fixação de nitrogênio
A fonte primária de nitrogênio para os seres vivos é o nitrogênio atmosférico, que tem que ser convertido a uma forma metabolizável como a amônia. Mas só algumas bactérias conseguem converter nitrogênio em amônia. A conversão de nitrogênio a amônia, chamada de fixação de nitrogênio, é feita por um sistema enzimatico complexo, denominado nitrogenase, que utiliza NADPH como doador de elétrons e só é processado com um consumo muito grande de ATP.
Essa classificação é dada em relação ao destino tomado pelo aminoácido quando o grupo amina é excretado do corpo na forma de uréia(mamíferos), amônia(peixes) e ácido úrico(Aves e répteis).
Destino cetogênico
Quando o álcool restante da quebra dos aminoácidos vai para qualquer fase do Ciclo de Krebs na forma de Acetil coenzima A ou outra substância.
Destino glicogênico
Quando o álcool restante da quebra dos aminoácidos vai para a via glicolítica.
Ocorrência
Os aminoácidos alfa ( cerca de vinte ) são constituintes de todas as proteínas e peptídeos, portanto, de toda a matéria viva.
Todos os aminoácidos constituintes das proteínas são alfa aminoácidos. As proteínas são alfa-polímeros formados por alfa-aminoácidos. Alguns autores relatam que para formar uma proteína é necessário uma cadeia com mais de 50 aminoácidos. Uma cadeia formada por dois alfa aminoácidos é um dipeptídeo, até 50 alfa-aminoácido um polipeptídeo.
Fixação de nitrogênio
A fonte primária de nitrogênio para os seres vivos é o nitrogênio atmosférico, que tem que ser convertido a uma forma metabolizável como a amônia. Mas só algumas bactérias conseguem converter nitrogênio em amônia. A conversão de nitrogênio a amônia, chamada de fixação de nitrogênio, é feita por um sistema enzimatico complexo, denominado nitrogenase, que utiliza NADPH como doador de elétrons e só é processado com um consumo muito grande de ATP.
AMINOÁCIDOS - Isomeria
Com exceção única da glicina, todos os aminoácidos obtidos pela hidrólise de proteínas em condições suficientemente suaves apresentam atividade óptica. Esses aminoácidos apresentam 4 grupos diferentes ligados ao carbono central, ou seja, esse carbono é assimétrico, assim esse carbono é chamado centro quiral. A existência de um centro quiral permite que esses aminoácidos formem esteroisômeros devido aos diferentes arranjos espaciais ópticamente ativos. Dentre os esteroisômeros existem aqueles que se apresentam como imagem espaculares um do outro sem sobreposição, a estes chamamos enantiômeros. Os enantiômeros podem ser D ou L, sendo essa classificação referente à semelhança com a estrutura do aminoácido D-gliceraldeído e do L-gliceraldeído, respectivamente. Somente os L-aminoácidos são constituintes das proteínas.
AMINOÁCIDOS - Síntese
Todos os aminoácidos são derivados de intermediários da glicólise, do ciclo do ácido cítrico ou das via das pentoses-fosfato. O nitrogênio entra nessas vias através do glutamato. Há uma grande variação no nível de complexidade das vias, sendo que alguns aminoácidos estão a apenas alguns passos enzimáticos dos seus precursores e em outros as vias são complexas, como no caso dos aminoácidos aromáticos.
Os aminoácidos podem ser essenciais ou não-essenciais.
Os aminoácidos não-essenciais são mais simples de serem sintetizados e o são pelos próprios mamíferos. Por isso eles não necessariamente precisam estar na alimentação.
Já os aminoácidos essenciais precisam está presentes na dieta, já que não são sintetizados pelos mamíferos.
As biossintéticas de aminoácidos são agrupadas de acordo com a família dos precursores de um deles. Existe a adição a esses precursores do PRPP (fosforribosil pirofosfato).
As principais famílias são:
A do alfa-cetoglutarato que origina o glutamato, a glutamina, a prolina e a arginina.
A do 3-fosfoglicerato de onde são derivados a serina, a glicina e a cisteína.
O oxaloacetato dá origem ao aspartato, que vai originar a asparagina, a metionina, a treonina e a lisina.
O piruvato dará origem a alanina, a valina, a leucina e a isoleucina.
Os aminoácidos podem ser essenciais ou não-essenciais.
Os aminoácidos não-essenciais são mais simples de serem sintetizados e o são pelos próprios mamíferos. Por isso eles não necessariamente precisam estar na alimentação.
Já os aminoácidos essenciais precisam está presentes na dieta, já que não são sintetizados pelos mamíferos.
As biossintéticas de aminoácidos são agrupadas de acordo com a família dos precursores de um deles. Existe a adição a esses precursores do PRPP (fosforribosil pirofosfato).
As principais famílias são:
A do alfa-cetoglutarato que origina o glutamato, a glutamina, a prolina e a arginina.
A do 3-fosfoglicerato de onde são derivados a serina, a glicina e a cisteína.
O oxaloacetato dá origem ao aspartato, que vai originar a asparagina, a metionina, a treonina e a lisina.
O piruvato dará origem a alanina, a valina, a leucina e a isoleucina.
AMINOÁCIDOS - Obtenção
Os aminoácidos são substâncias anfóteras, ou seja, pode atuar como ácidos ou como bases.
Existem 2 grupos ácidos fracos ionizados, um –COOH e um –NH3 + . Em solução essas duas formas estão em equilíbrio protônico. R-COOH e R-NH3 +, representam a forma protonada ou ácida, parceiras nesse equilíbrio. E as formas R-COO- e R-NH2 são as bases conjugadas.
Assim, dependendo do meio, os aminoácidos podem atuar como ácidos(protonado, podendo doar prótons), neutros(a forma protonada e a forma receptora de prótons em equilíbrio) e base (base conjugada do ácido correspondente, ou seja, perdeu prótons, e agora é receptora deles).
Os aminoácidos reagem com o ácido nitroso produzindo nitrogênio e um hidroxi-acido. A aplicação desta reação é a determinação da dosagem de aminoácidos,no sangue, medindo-se o o volume de nitrogênio produzido (método de Slyke).
Na putrefação dos organismos, certas enzimas reduzem os aminoácidos em aminas como a putrescina e a cadaverina.
Existem 2 grupos ácidos fracos ionizados, um –COOH e um –NH3 + . Em solução essas duas formas estão em equilíbrio protônico. R-COOH e R-NH3 +, representam a forma protonada ou ácida, parceiras nesse equilíbrio. E as formas R-COO- e R-NH2 são as bases conjugadas.
Assim, dependendo do meio, os aminoácidos podem atuar como ácidos(protonado, podendo doar prótons), neutros(a forma protonada e a forma receptora de prótons em equilíbrio) e base (base conjugada do ácido correspondente, ou seja, perdeu prótons, e agora é receptora deles).
Os aminoácidos reagem com o ácido nitroso produzindo nitrogênio e um hidroxi-acido. A aplicação desta reação é a determinação da dosagem de aminoácidos,no sangue, medindo-se o o volume de nitrogênio produzido (método de Slyke).
Na putrefação dos organismos, certas enzimas reduzem os aminoácidos em aminas como a putrescina e a cadaverina.
AMINOÁCIDOS - Ionização
Os aminoácidos são substâncias anfóteras, ou seja, pode atuar como ácidos ou como bases.
Existem 2 grupos ácidos fracos ionizados, um –COOH e um –NH3 + . Em solução essas duas formas estão em equilíbrio protônico. R-COOH e R-NH3 +, representam a forma protonada ou ácida, parceiras nesse equilíbrio. E as formas R-COO- e R-NH2 são as bases conjugadas.
Assim, dependendo do meio, os aminoácidos podem atuar como ácidos(protonado, podendo doar prótons), neutros(a forma protonada e a forma receptora de prótons em equilíbrio) e base (base conjugada do ácido correspondente, ou seja, perdeu prótons, e agora é receptora deles).
Os aminoácidos reagem com o ácido nitroso produzindo nitrogênio e um hidroxi-acido. A aplicação desta reação é a determinação da dosagem de aminoácidos,no sangue, medindo-se o o volume de nitrogênio produzido (método de Slyke).
Na putrefação dos organismos, certas enzimas reduzem os aminoácidos em aminas como a putrescina e a cadaverina.
Existem 2 grupos ácidos fracos ionizados, um –COOH e um –NH3 + . Em solução essas duas formas estão em equilíbrio protônico. R-COOH e R-NH3 +, representam a forma protonada ou ácida, parceiras nesse equilíbrio. E as formas R-COO- e R-NH2 são as bases conjugadas.
Assim, dependendo do meio, os aminoácidos podem atuar como ácidos(protonado, podendo doar prótons), neutros(a forma protonada e a forma receptora de prótons em equilíbrio) e base (base conjugada do ácido correspondente, ou seja, perdeu prótons, e agora é receptora deles).
Os aminoácidos reagem com o ácido nitroso produzindo nitrogênio e um hidroxi-acido. A aplicação desta reação é a determinação da dosagem de aminoácidos,no sangue, medindo-se o o volume de nitrogênio produzido (método de Slyke).
Na putrefação dos organismos, certas enzimas reduzem os aminoácidos em aminas como a putrescina e a cadaverina.
AMINOÁCIDOS - Propriedades
Organolépticas: Incolores. A maioria de sabor adocicado.
Físicas: Sólidos com solubilidade variável em água. Apresentam atividade óptica por apresentarem carbono assimétrico, em geral,na forma levógira. A glicina é solúvel em água e não apresenta atividade óptica
Químicas: O grupo carboxílico (-COOH) na molécula confere ao aminoácido uma caracteristica ácida e o grupo amino (-NH2) uma caracteristica básica. Por isso, os aminoácidos apresentam um caráter anfótero, ou seja, reagem tanto com ácidos como com bases formando sais orgânicos.
Físicas: Sólidos com solubilidade variável em água. Apresentam atividade óptica por apresentarem carbono assimétrico, em geral,na forma levógira. A glicina é solúvel em água e não apresenta atividade óptica
Químicas: O grupo carboxílico (-COOH) na molécula confere ao aminoácido uma caracteristica ácida e o grupo amino (-NH2) uma caracteristica básica. Por isso, os aminoácidos apresentam um caráter anfótero, ou seja, reagem tanto com ácidos como com bases formando sais orgânicos.
AMINOÁCIDOS - Curva de titulação
É muito comum o uso da titulação através da adição ou remoção de prótons para se descobrir características dos compostos. Para aminoácidos essas características também são evidentes. Os valores dessa curva variam entre os aminoácidos. Porém esta tem algumas características em comum.
No início da curva observa-se que os grupos dos aminoácidos carboxilo e amino estão completamente protonados. Com a titulação o grupo carboxílico vai liberar prótons. Durante essa liberação é evidenciado um ponto onde a concentração desse doador de prótons é igual à concentração do íon dipolar desse aminoácido, ponto de inflexão, correspondente a pH igual a pK (medidor da tendência de ceder prótons) do grupo protonado que não está sendo titulado.
O ponto onde se observa o fim da liberação de prótons por parte do carboxilo é o ponto isoelétrico, pI, esse ponto possui um pH caraterístico, onde se observa todo o aminoácido como íon dipolar, ou seja, a carga total é igual a zero. Com a continuação da titulação, o próton do grupo NH3+ será liberado. Também se observa um ponto de inflexão nessa segunda parte da curva de titulação.
No início da curva observa-se que os grupos dos aminoácidos carboxilo e amino estão completamente protonados. Com a titulação o grupo carboxílico vai liberar prótons. Durante essa liberação é evidenciado um ponto onde a concentração desse doador de prótons é igual à concentração do íon dipolar desse aminoácido, ponto de inflexão, correspondente a pH igual a pK (medidor da tendência de ceder prótons) do grupo protonado que não está sendo titulado.
O ponto onde se observa o fim da liberação de prótons por parte do carboxilo é o ponto isoelétrico, pI, esse ponto possui um pH caraterístico, onde se observa todo o aminoácido como íon dipolar, ou seja, a carga total é igual a zero. Com a continuação da titulação, o próton do grupo NH3+ será liberado. Também se observa um ponto de inflexão nessa segunda parte da curva de titulação.
AMINOÁCIDOS - Outros
Ácido β-aminopropiônico (β-alanina): aminoácido natural componente do ácido pantotênico (vitamina do grupo B).
Aminoácidos ômega
Ácido ω-aminocapróico: aminoácido sintético usado na fabricação de fibras sintéticas e de plásticos.
"Aminoácidos" nocivos
Aminoácidos ômega
Ácido ω-aminocapróico: aminoácido sintético usado na fabricação de fibras sintéticas e de plásticos.
"Aminoácidos" nocivos
PROTEÍNAS - Introdução
As proteínas são compostos orgânicos de estrutura complexa e massa molecular elevada (de 5 000 a 1 000 000 ou mais unidades de massa atómica) e são sintetizadas pelos organismos vivos através da condensação de um grande número de moléculas de alfa-aminoácidos, através de ligações denominadas ligações peptídicas.
Uma grande parte das proteínas são completamente sintetizadas no citosol das células pela tradução do RNA enquanto as proteínas destinadas à membrana citoplasmática, lisossomas e as proteínas de secreção possuem um sinal que é reconhecido pela membrana do reticulo endoplasmático onde terminam sua síntese.
São compostos quaternários de carbono (C), hidrogênio (H), oxigênio (O) e azoto (N) - também chamado de nitrogênio no Brasil. São constituídas por dois grupos funcionais: o grupo amina (R-NH-) e o grupo carboxilo (R-CO-), derivados dos aminoácidos e que estabelecem as ligações peptídicas.
Existem 23 aminoácidos conhecidos, dos quais oito são ditos essenciais: o organismo humano não é capaz de produzi-los, e por isso é necessária a sua ingestão através dos alimentos para evitar sua deficiência no organismo. Uma cadeia de aminoácidos denomina-se de "peptídeo", estas podem possuir dois aminoácidos (dipeptídeos), três aminoácidos (tripeptídeos), quatro aminoácidos (tetrapeptídeos), ou muitos aminoácidos (polipeptídeos). O termo proteína é dado quando na composição do polipeptídeo entram centenas ou milhares de aminoácidos.
As ligações entre aminoácidos denominam-se ligações peptídicas e estabelecem-se entre o grupo amina de um aminoácido e o grupo carboxilo de outro aminoácido, com a perda de uma molécula de água.
Uma grande parte das proteínas são completamente sintetizadas no citosol das células pela tradução do RNA enquanto as proteínas destinadas à membrana citoplasmática, lisossomas e as proteínas de secreção possuem um sinal que é reconhecido pela membrana do reticulo endoplasmático onde terminam sua síntese.
São compostos quaternários de carbono (C), hidrogênio (H), oxigênio (O) e azoto (N) - também chamado de nitrogênio no Brasil. São constituídas por dois grupos funcionais: o grupo amina (R-NH-) e o grupo carboxilo (R-CO-), derivados dos aminoácidos e que estabelecem as ligações peptídicas.
Existem 23 aminoácidos conhecidos, dos quais oito são ditos essenciais: o organismo humano não é capaz de produzi-los, e por isso é necessária a sua ingestão através dos alimentos para evitar sua deficiência no organismo. Uma cadeia de aminoácidos denomina-se de "peptídeo", estas podem possuir dois aminoácidos (dipeptídeos), três aminoácidos (tripeptídeos), quatro aminoácidos (tetrapeptídeos), ou muitos aminoácidos (polipeptídeos). O termo proteína é dado quando na composição do polipeptídeo entram centenas ou milhares de aminoácidos.
As ligações entre aminoácidos denominam-se ligações peptídicas e estabelecem-se entre o grupo amina de um aminoácido e o grupo carboxilo de outro aminoácido, com a perda de uma molécula de água.
PROTEÍNAS - Composição
Quanto a estrutura molecular as proteínas são classificadas em:
Proteínas constituídas somente por aminoácidos como, por exemplo, a queratina (cabelo). A hidrólise completa dessas proteínas produz unicamente α-aminoácidos.
Proteínas complexas, conjugadas ou heteroproteínas: proteínas que apresentam a cadeia de aminoácidos ligada a um radical diferente (grupo prostético). Dependendo do grupo prostético, as proteínas podem ser classificadas em:
· Glicoproteínas: o grupo é um glicídio. Exemplos: mucina (saliva) e osteomucóide (ossos).
· Cromoproteínas: o grupo é um pigmento. Exemplos: clorofila (vegetais verdes) e hemoglobina (sangue).
· Fosfoproteínas: o grupo é o ácido fosfórico. Exemplos: vitelina (gema do ovo) e caseina (leite).
· Nucleoproteínas: o grupo é um ácido heterocíclico complexo.
· A hidrólise completa dessas proteínas produz α-aminoácidos e grupos prostéticos.
Proteínas constituídas somente por aminoácidos como, por exemplo, a queratina (cabelo). A hidrólise completa dessas proteínas produz unicamente α-aminoácidos.
Proteínas complexas, conjugadas ou heteroproteínas: proteínas que apresentam a cadeia de aminoácidos ligada a um radical diferente (grupo prostético). Dependendo do grupo prostético, as proteínas podem ser classificadas em:
· Glicoproteínas: o grupo é um glicídio. Exemplos: mucina (saliva) e osteomucóide (ossos).
· Cromoproteínas: o grupo é um pigmento. Exemplos: clorofila (vegetais verdes) e hemoglobina (sangue).
· Fosfoproteínas: o grupo é o ácido fosfórico. Exemplos: vitelina (gema do ovo) e caseina (leite).
· Nucleoproteínas: o grupo é um ácido heterocíclico complexo.
· A hidrólise completa dessas proteínas produz α-aminoácidos e grupos prostéticos.
PROTEÍNAS - Estrutura Tridimensional
As proteínas podem ter 4 tipos de estrutura dependendo do seu tipo de aminoácidos que possui, do tamanho da cadeia e da configuração espacial da cadeia polipeptídica. As estruturas são:
Estrutura primária:
É dada pela seqüência de aminoácidos ao longo da cadeia polipeptídica. É o nível estrutural mais simples e mais importante, pois dele deriva todo o arranjo espacial da molécula. São específicas para cada proteína, sendo geralmente determinados geneticamente. Um exemplo de proteína são os ovos,feijão soja e etc.. A estrutura primária da proteína resulta em uma longa cadeia de aminoácidos semelhante a um "colar de contas", com uma extremidade "amino terminal" e uma extremidade "carboxi terminal". Sua estrutura é somente a seqüência dos aminoácidos, sem se preocupar com a orientação espacial da molécula.
Estrutura secundária:
É dada pelo arranjo espacial de aminoácidos próximos entre si na seqüência primária da proteína. É o último nível de organização das proteínas fibrosas, mais simples estruturalmente.
Ocorre graças à possibilidade de rotação das ligações entre os carbonos a dos aminoácidos e seus grupamentos amina e carboxila. O arranjo secundário de um polipeptídeo pode ocorrer de forma regular; isso acontece quando os ângulos das ligações entre carbonos a e seus ligantes são iguais e se repetem ao longo de um segmento da molécula.
São dois os tipos principais de arranjo secundário regular:
alfa-hélice;
folha-beta.
Estrutura terciária:
Resulta do enrolamento da hélice ou da folha pregueada, sendo mantido por pontes de hidrogénio e dissulfito. Esta estrutura confere a actividade biológica às proteínas.
A estrutura terciária descreve o dobramento final de uma cadeia, por interações de regiões com estrutura regular ou de regiões sem estrutura definida. Podendo haver interações de segmentos distantes de estrutura primária, por ligações não covalentes.
Enquanto a estrutura secundária é determinada pelo relacionamento estrutural de curta distância, a terciária é caracterizada pelas interações de longa distância entre aminoácidos. Todas têm seqüências de aminoácidos diferentes, refletindo estruturas e funções diferentes
Estrutura quaternária:
Algumas proteínas podem ter duas ou mais cadeias polipeptídicas. E essa transformação das proteínas em estruturas tridimensionais é a estrutura quaternária. Elas guiadas e estabilizadas pela mesmas interações da terciária.A junção de cadeias polipeptídicas podem produzir diferentes funções para os compostos.
Um dos principais exemplos de estrutura quaternária é a hemoglobina. Sua estrutura é formada por quatro cadeias polipeptídicas.
Estrutura primária:
É dada pela seqüência de aminoácidos ao longo da cadeia polipeptídica. É o nível estrutural mais simples e mais importante, pois dele deriva todo o arranjo espacial da molécula. São específicas para cada proteína, sendo geralmente determinados geneticamente. Um exemplo de proteína são os ovos,feijão soja e etc.. A estrutura primária da proteína resulta em uma longa cadeia de aminoácidos semelhante a um "colar de contas", com uma extremidade "amino terminal" e uma extremidade "carboxi terminal". Sua estrutura é somente a seqüência dos aminoácidos, sem se preocupar com a orientação espacial da molécula.
Estrutura secundária:
É dada pelo arranjo espacial de aminoácidos próximos entre si na seqüência primária da proteína. É o último nível de organização das proteínas fibrosas, mais simples estruturalmente.
Ocorre graças à possibilidade de rotação das ligações entre os carbonos a dos aminoácidos e seus grupamentos amina e carboxila. O arranjo secundário de um polipeptídeo pode ocorrer de forma regular; isso acontece quando os ângulos das ligações entre carbonos a e seus ligantes são iguais e se repetem ao longo de um segmento da molécula.
São dois os tipos principais de arranjo secundário regular:
alfa-hélice;
folha-beta.
Estrutura terciária:
Resulta do enrolamento da hélice ou da folha pregueada, sendo mantido por pontes de hidrogénio e dissulfito. Esta estrutura confere a actividade biológica às proteínas.
A estrutura terciária descreve o dobramento final de uma cadeia, por interações de regiões com estrutura regular ou de regiões sem estrutura definida. Podendo haver interações de segmentos distantes de estrutura primária, por ligações não covalentes.
Enquanto a estrutura secundária é determinada pelo relacionamento estrutural de curta distância, a terciária é caracterizada pelas interações de longa distância entre aminoácidos. Todas têm seqüências de aminoácidos diferentes, refletindo estruturas e funções diferentes
Estrutura quaternária:
Algumas proteínas podem ter duas ou mais cadeias polipeptídicas. E essa transformação das proteínas em estruturas tridimensionais é a estrutura quaternária. Elas guiadas e estabilizadas pela mesmas interações da terciária.A junção de cadeias polipeptídicas podem produzir diferentes funções para os compostos.
Um dos principais exemplos de estrutura quaternária é a hemoglobina. Sua estrutura é formada por quatro cadeias polipeptídicas.
PROTEÍNAS - Classificação
pode-se classificar as proteínas em três grupos: - Proteínas simples - São também denominadas de homoproteínas e são constituídas, exclusivamente por aminoácidos. Em outras palavras, fornecem exclusivamente uma mistura de aminoácidos por hidrólise. Pode-se mencionar como exemplo: As Albuminas - São as de menor peso molecular - São encontradas nos animais e vegetais. - São solúveis na água. Exemplos: albumina do plasma sangüíneo e da clara do ovo. As Globulinas - Possuem um peso molecular um pouco mais elevado. - São encontradas nos animais e vegetais - São solúveis em água salgada. Exemplos: anticorpos e fibrinogênio. As Escleroproteínas ou proteínas fibrosas - Possuem peso molecular muito elevado. - São exclusivas dos animais. - São insolúveis na maioria dos solventes orgânicos. Exemplos: colágeno, elastina e queratina. - Proteínas Conjugadas - São também denominadas heteroproteínas. As proteínas conjugadas são constituídas por aminoácidos mais outro componente não-protéico, chamado grupo prostético.
- Proteínas Derivadas -As proteínas derivadas formam-se a partir de outras por desnaturação ou hidrólise. Pode-se citar como exemplos desse tipo de proteínas as proteoses e as peptonas, formadas durante a digestão.
- Proteínas Derivadas -As proteínas derivadas formam-se a partir de outras por desnaturação ou hidrólise. Pode-se citar como exemplos desse tipo de proteínas as proteoses e as peptonas, formadas durante a digestão.
PROTEÍNAS - Funções
· Estrutural ou plástica
São aquelas que participam dos tecidos dando-lhes rigidez, consistência e elasticidade. São proteínas estruturais: colágeno (constituínte das cartilagens), actina e miosina (presentes na formação das fibras musculares), queratina (principal proteína do cabelo), fibrinogênio (presente no sangue), albumina (encontrada em ovos) e outras.
· Hormonal
Exercem alguma função específica sobre algum órgão ou estrutura de um organismo como, por exemplo, a insulina (embora tecnicamente a insulina seja considerada apenas um polipeptídeo, devido a seu pequeno tamanho).
· Defesa
Os anticorpos são proteínas que realizam a defesa do organismo, especializados no reconhecimento e neutralização de vírus, bactérias e outras substâncias estranhas.
O fibrinogênio e a trombina são outras proteínas responsáveis pela coagulação do sangue e prevenção de perda sanguínea em casos de cortes e machucados.
· Energética
Obtenção de energia a partir dos aminoácidos que compõem as proteínas.
· Enzimática
Enzimas são proteínas capazes de catalizar reações bioquímicas como, por exemplo, as lípases. As enzimas não reagem, são reutilizadas (sempre respeitando o sítio ativo) e são específicas.
As enzimas reduzem a energia de ativação das reações químicas. A função da enzima depende diretamente de sua estrutura.
Proteínas altamente especializadas e com atividade catalítica. Mais de 2000 enzimas são conhecidas, cada uma capaz de catalisar um tipo diferente de reação química.
· Condutoras de gases:
O transporte de gases (principalmente do oxigênio e um pouco do gás carbônico) é realizado por proteínas como a hemoglobina e hemocianina.
São aquelas que participam dos tecidos dando-lhes rigidez, consistência e elasticidade. São proteínas estruturais: colágeno (constituínte das cartilagens), actina e miosina (presentes na formação das fibras musculares), queratina (principal proteína do cabelo), fibrinogênio (presente no sangue), albumina (encontrada em ovos) e outras.
· Hormonal
Exercem alguma função específica sobre algum órgão ou estrutura de um organismo como, por exemplo, a insulina (embora tecnicamente a insulina seja considerada apenas um polipeptídeo, devido a seu pequeno tamanho).
· Defesa
Os anticorpos são proteínas que realizam a defesa do organismo, especializados no reconhecimento e neutralização de vírus, bactérias e outras substâncias estranhas.
O fibrinogênio e a trombina são outras proteínas responsáveis pela coagulação do sangue e prevenção de perda sanguínea em casos de cortes e machucados.
· Energética
Obtenção de energia a partir dos aminoácidos que compõem as proteínas.
· Enzimática
Enzimas são proteínas capazes de catalizar reações bioquímicas como, por exemplo, as lípases. As enzimas não reagem, são reutilizadas (sempre respeitando o sítio ativo) e são específicas.
As enzimas reduzem a energia de ativação das reações químicas. A função da enzima depende diretamente de sua estrutura.
Proteínas altamente especializadas e com atividade catalítica. Mais de 2000 enzimas são conhecidas, cada uma capaz de catalisar um tipo diferente de reação química.
· Condutoras de gases:
O transporte de gases (principalmente do oxigênio e um pouco do gás carbônico) é realizado por proteínas como a hemoglobina e hemocianina.
Assinar:
Postagens (Atom)